技术简介
蛋白质作为生命形态中最重要的分子,一直以来都是全球科学家们研究的焦点。免疫沉淀技术是以抗体与抗原间的专一性为基础用于研究蛋白质相互作用的经典方法,也是确定两种蛋白质在细胞内相互性生理作用的有效方法。表现为可溶性抗原与相应抗体在液相或凝胶中特异性结合后,形成的免疫复合物在一定条件下出现蛋白质析出。免疫沉淀与凝集反应、中和反应、补体参与的抗原抗体反应并称经典免疫学技术。随着对蛋白质研究的不断深入,人们将免疫沉淀方法与其他方法相结合,在其基础上衍生出很多更为复杂的技术,使蛋白质分析方法更为多样化,应用范围更为广泛。该技术现已广泛应用于基因、蛋白质以及其相互作用等研究领域。
免疫沉淀技术的发展
免疫沉淀技术的基本策略就是利用抗体与相应抗原的高亲和力特性检出和结合溶液中靶分子。免疫沉淀技术从诞生起就一直随着科技的发展而进步。早期,研究人员利用凝胶电泳分辨免疫沉淀蛋白,将抗原溶液加入琼脂糖之类的可渗透基质的小孔内,并在邻近孔内加入抗血清,随着抗原抗体扩散,大分子进入凝胶内,两者相互作用,形成由多个抗体分子与抗原桥联组成的复合物,通过抗体和抗原的扩散形成浓度梯度,并在最适浓度处形成多分子网络复合物,最终大分子蛋白复合物从溶液中析出形成肉眼可见的沉淀线。免疫沉淀的早期改进方向是促进多聚体反应,使免疫复合物从溶液中析出。随后,研究人员发现利用第二抗体与免疫复合物中的抗体形成网络结构,可以不必对每种抗原的第一抗体进行滴定实验,这种方法一直沿用至今。20世纪70年代中期,人们开始采用固相反应,利用固定在金黄色葡萄球菌表面的蛋白A吸附抗体,再与相应抗原结合。随着科技的发展,目前这种方法已改进为利用表面固定了蛋白A或蛋白G的微球来分离抗原抗体复合物,以达到检测抗原或目标蛋白的目的。
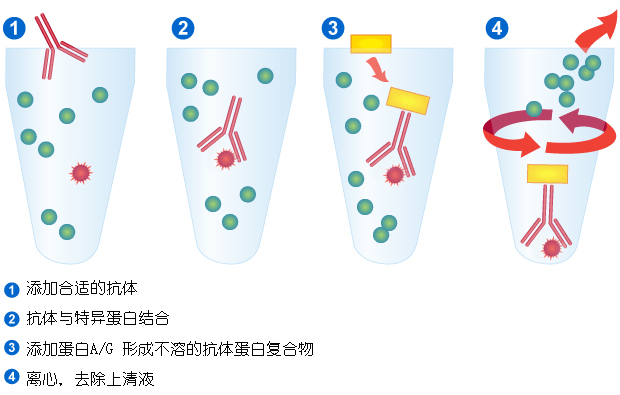
图1 经典免疫沉淀过程图解
免疫沉淀技术的分类
随着对蛋白质研究的不断深入,人们将免疫沉淀方法与其他方法相结合,在其基础上衍生出很多更为复杂的技术,使蛋白质分析方法更为多样化,应用范围更为广泛。该技术现已广泛应用于基因、蛋白质以其相互作用等研究领域。按应用范围分类,可分为以下四类:
- 1) 免疫沉淀(Individual protein immunoprecipitation, IP):利用抗体特异性从细胞裂解物或其他可溶性生物样品中纯化已知特定蛋白质。IP与SDS-PAGE方法联用时,可达到测量蛋白质相对分子量,对已知抗原定量,确定蛋白质降解速率等目的。
- 2) 免疫共沉淀(Protein complex immunoprecipitation , Co-IP):利用抗体沉淀相应特定抗原,同时沉淀与该抗原相互结合的其他分子,主要用于研究蛋白质相互作用。Co-IP与WB或质谱方法结合,可用于确定特定蛋白-兴趣蛋白在天然状态下的结合情况,确定特定蛋白质的新作用搭档。
- 3) 染色质免疫沉淀(Chromatin immunoprecipitation, ChIP):在活细胞状态下固定蛋白质-DNA复合物,并将其随机切断,通过免疫沉淀复合体特异性富集目的蛋白结合的DNA片段,再通过对DNA片段的纯化和检测,获得蛋白质与DNA相互作用的信息。ChIP不仅可以检测体内反式因子与DNA的动态作用,还可用于研究组蛋白的各种共价修饰与基因表达间的关系。将ChIP与基因芯片相结合形成的ChIP-on-chip方法,可用于特定反式因子靶基因的高通量筛选;ChIP与体内足迹法相结合,可用于寻找反式因子的体内结合位点。
- 4) RNA免疫沉淀(RNA immunoprecipitation, RIP):其原理与ChIP相近,但RNA免疫沉淀是用来研究与蛋白质结合的RNA在基因表达调控中的作用。
免疫沉淀的关键影响因素
每种免疫沉淀方法都有一套固定的操作程序,但都是以抗原-抗体特异性结合为基础。目前常规操作是利用共价结合蛋白A或蛋白G的琼脂糖或磁性微球将反应后的抗原-抗体复合物富集纯化。蛋白A和蛋白G能特异地和抗体的保守区Fc段结合,形成稳定的抗原-抗体复合物附着在微球上(示意图见图2),溶液内无关的分子可以通过洗涤微球被清除,最后,再采用一系列方法分析纯化抗原或与抗原结合的其他分子。整个过程中值得注意的几个关键影响因素如下:
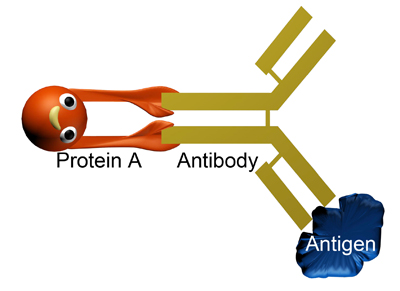
图2 蛋白A-抗体-抗原复合物示意图
- 1) 样品处理的质量
免疫沉淀实验成功的关键在于第一步样品处理。免疫沉淀实验本质是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中抗原的质量,如抗原的丰度及抗原的构象状态。
样品处理应根据抗原样品的来源如组织样品、细胞或其他形式的样品,选择适当的方式进行细胞或组织破碎,使待检抗原释放至样品溶液中。裂解缓冲液的使用应注意添加合适的蛋白酶抑制,避免抗原或抗原-其他分子复合物被降解,另外,应选用去垢剂强度合适的裂解液,既保证有效裂解细胞释放抗原又不破坏蛋白质之间的相互作用。
- 2) 抗体的选择
在考虑抗体特异性的同时,还需考虑抗体对抗原的亲和力,如单克隆抗体只对抗原的单一表位具有良好的特异性,因此在免疫沉淀中如果抗原表位暴露不充分,受到破坏,或受其他因素影响,造成抗体不能识别抗原,无法有效形成免疫沉淀复合物,那么这将直接影响免疫沉淀的结果。而多克隆抗体或混合单克隆抗体可以和抗原的多个表位结合,从而解决亲和力的问题。但是,并不是所有抗体都能用于免疫沉淀,应选用经IP实验验证后的抗体以确保实验结果的可靠性。此外,不同类型、同类不同亚型的抗体对蛋白 A或G的亲和力不同,应选择合适的抗体及微球用于免疫沉淀。
- 3) 微球的选择
目前广泛应用于免疫沉淀的微球以结合了蛋白 A或G的琼脂糖和磁性微球为主(微球见图3)。琼脂糖材料是无色透明、粒径达微米级的具有多孔表面的微球,有巨大的表面积,蛋白结合量高,曾一度成为免疫沉淀技术中的主要材料。但在免疫沉淀操作中需要采用离心的方法达到固液分离,而反复离心产生的物理应力极易破坏蛋白的天然构象及完整性,且由于琼脂糖本身容易破碎,不易保存,限制了琼脂糖微球在免疫沉淀中的发展。相比之下,磁性微球其核心为超顺磁性粒子,核心外层包裹一层高分子材料,表面平滑,粒径可达纳米级,比表面积大,单位重量的微球蛋白结合量更大。超顺磁性微球可以在外加磁场中表现磁性,实现快速有效分离,大大缩短实验操作时间。温和的磁性分离方式避免反复离心对蛋白天然构象及完整性的破坏。超顺磁性微球在增大机械强度和稳定性的同时,缩减了产品造价。上述的优势使超顺磁性微球成为免疫沉淀试剂盒行业的新秀,逐渐被研究者所采用。
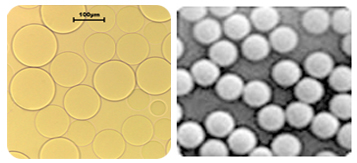
图3 琼脂糖(左)与磁性微球(右)示意图
免疫沉淀实验操作流程
以共价结合蛋白A或G的磁性微球为例,免疫沉淀操作的基本流程如下:
- 1) 抗原样品的制备:①血清或细胞分泌上清液等:根据目标蛋白的丰度适当调整抗原原液浓度。②细胞裂解上清液:样品是悬浮细胞,离心收集后用PBS洗涤2次,按比例加入细胞裂解液冰上裂解一定时间,离心收集上清液;样品是贴壁细胞,移去培养基后用PBS洗涤2次,把细胞刮脱收集至EP管,按比例加入细胞裂解液冰上裂解细胞一定时间,离心收集上清液。③细菌裂解上清液:每克菌体按比例加入裂解缓冲液重悬,简短超声裂解细胞,离心收集上清液。如样品来源于组织或其他形式样品,也应选择合适的裂解缓冲液及方式进行破碎,使待检抗原释放至样品溶液中。
- 2) 磁性微球与抗体结合反应:①磁珠的准备及预平衡:取一定量磁珠悬液至EP管内,把EP管置于磁性分离器上分离固液,用Binding Buffer洗涤2遍;②抗体与磁珠反应:用Binding Buffer将所需抗体稀释至一定体积,与预平衡后的磁珠混合反应一定时间,反应结束后通过磁性分离移走上清液;③磁珠-抗体复合物的洗涤:从磁性分离器上取下EP管,加入Binding Buffer用微量移液器轻吹抗体-磁珠复合物使其均匀分散,再经磁性分离移走上清,重复操作1次,去除残留未结合抗体和其他杂质等。
- 3) 抗原沉淀反应:①抗原与抗体反应:向抗体-磁珠复合物中加入一定体积的抗原溶液,用移液器轻吹使磁珠分散均匀,孵育时间及温度根据抗体与抗原结合强弱适当调整,反应结束后通过磁性分离移走上清;②磁珠-抗体-抗原复合物的洗涤:加入一定体积Washing Buffer轻吹磁珠使其分散,通过磁性分离移走上清,重复操作2次,是去除非特异性粘附的蛋白及杂质。③加入一定体积Washing Buffer轻吹磁珠,用移液器将悬液转移至新的EP管中,以为避免原管壁上非特异性吸附的蛋白被一起洗脱,影响免疫沉淀结果。
- 4) 抗原/抗原-其他分子复合物的洗脱及鉴定:①变性洗脱:磁珠-抗体-抗原复合物与一定体积1×SDS Loading Buffer混合加热,通过磁性分离收集的上清液可直接用于SDS-PAGE检测;②非变性洗脱(复合物保持完整可用于后期功能分析):磁珠-抗体-抗原复合物与一定体积Elution Buffer混合反应一定时间,通过磁性分离收集上清液,如果Elution Buffer的pH较低,收集上清液后立即用碱性缓冲液调节pH至中性。
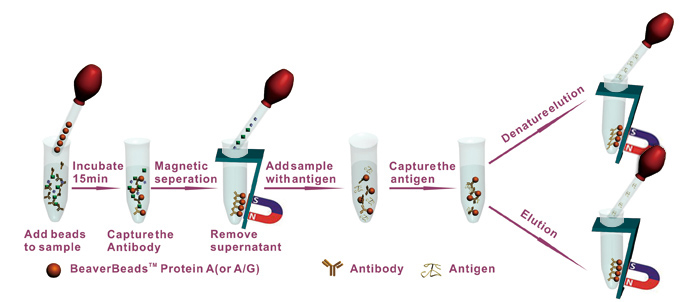
图4 免疫沉淀操作流程示意图
作为蛋白质研究中的重要技术,国内外各大公司都在不断地开发与免疫沉淀技术相关的产品。目前免疫沉淀产品系列丰富、涵盖范围广,能够满足研究者的不同需求。对于刚刚开始使用免疫沉淀技术的研究人员来说,使用成熟的商品化试剂盒和相关的技术服务会达到事半功倍的效果,现已有一些质量优异的品牌如Invitrogen DynalBeads、ThermoFisher以及BeaverBeads等。







 京公网安备 11010802034257号
京公网安备 11010802034257号